Je sais effectuer un calcul si …
- J’ai écrit la formule littérale adéquate
- J’ai personnalisé la formule littérale
- J’ai calculé correctement (calculette + conversion)
- J’ai mis le bon nombre de chiffres significatifs CS
- J’ai mis la bonne unité à la fin du calcul
Exercice 1 : Soude
Pour préparer 250 mL d’une solution aqueuse de soude (ou hydroxyde de sodium NaOH), nous avons prélevé 0,021 mole de soude et l’avons dissout avec de l’eau distillée dans une fiole de 250 mL. Quelle est la concentration en quantité de matière de soude en mol/L ?
Donc la concentration en quantité de matière de soude est de 84 mmol/L
Exercice 2 : Volume de solution
On souhaite prélever un volume de solution contenant 0,10 mole de sulfate de fer (FeSO4) qui se trouve dissout dans une solution à 5,40 mol/L. Déterminer le volume de solution à prélever avec une pipette.
Donc le volume de solution à prélever sera de 19 mL. Vu la précision et la valeur, on utilisera une pipette graduée et non une pipette jaugée.
Exercice 3 : Masse de sel
Un chimiste veut préparer une solution de sel (chlorure de sodium NaCl) avec une concentration molaire de 0,21 mol/L. Quelle masse de sel devra-t-il prélever pour réaliser un solution de 650 mL ?
On ne peut pas calculer la masse tout de suite : les données de l’exercice ne nous permettent de déterminer qu’une quantité de matière en sel.

On peut alors calculer la masse puisque la masse molaire de sel se détermine facilement.
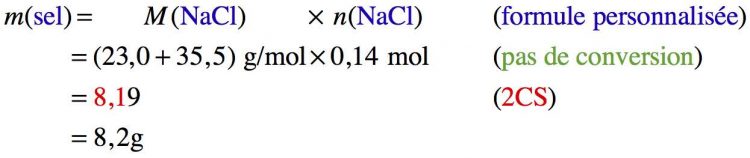
On cherche une masse à partir d’un volume et d’une concentration en quantité de matière… On va donc insérer la formule de la concentration en quantité de matière ( n = C ∙ V ) dans celle de la masse molaire ( m = M ∙ n ) :
\( n = M \cdot \mathbf{C \cdot V} \)
\( m(\mathrm{NaCl})=M(\mathrm{NaCl})\times C(\mathrm{NaCl})\times n(\mathrm{NaCl}) \)
\( m = (23,0 + 35,5) \times 0,21 \times 0,650 \)
\( m = (23,0 + 35,5) \times 0,21 \times 0,650 \)
\( m = 7,98525 = 8,0 \ \mathrm{g} \)
Donc la masse de sel à prélever, avec une spatule et une balance, est de 8,0 g (méthode conseillée) ou de 8,2 g (méthode moins précise). Il faudra utiliser une balance de laboratoire précise au dixième de gramme près (ou au centième ; cela marche aussi)
Exercice 4 : Concentration des ions dissouts
On dispose d’une solution de nitrate de cuivre II, de formule chimique Cu(NO3)2, ayant une concentration en quantité de matière C1 = 0,35 mol/L. Déterminer les concentrations effectives des ions dissouts dans la solution aqueuse de nitrate de cuivre II.
Équation de dissolution : Cu(NO3)2 —> Cu2+ + 2 NO3–
Une simple lecture de cette équation nous permet de dire qu’il se formera suite à la dissolution de 1 mole de Cu(NO3)2 :
- 1 mole de Cu2+
- 2 mole de NO3–.
En écriture symbolique, cela se traduit par :
- nf (Cu2+) = ni (CuNO3)2)
- nf (NO3–) = 2 ni (CuNO3)2)
Donc si on divise par le volume de solution V(solution) on obtient :

Donc

Exercice 5 : Masse à prélever pour une certaine quantité d'ions
On souhaite préparer, par dissolution de nitrate de cuivre II solide (formule chimique Cu(NO3)2, 200 mL de solution qui aura une concentration en ion nitrate NO3– de 2,4 x 10-2 mol/L. Quelle masse de nitrate de cuivre II solide devra-t-on peser ?
De l’exercice 4 précédent, on sait maintenant que :
- nf (NO3–) = 2 ni (Cu(NO3)2)
Donc si on divise chaque membre de la relation précédente par V(solution), on arrive à :
- [NO3–] = 2 C (Cu(NO3)2)
- Alors C (Cu(NO3)2) = [NO3–] /2 = 1,2 × 10-2 mol/L
Donc pour obtenir [NO3–] = 2,4 × 10-2 mol/L en solution, il faut que la concentration en soluté apportée soit : C (Cu(NO3)2) = 1,2 × 10-2 mol/L
Formule avec la masse de nitrate de cuivre à peser :
- m = Cm(Cu(NO3)2) · V(solution)
- m = M(Cu(NO3)2) · C(Cu(NO3)2) · V(solution)
- m = 187,5 × 1,2 × 10-2 × 0,200 = 0,45 g
Donc la masse de nitrate de cuivre II à prélever, avec une spatule et une balance, est de 0,45 g. Il faudra utiliser une balance de laboratoire précise au centième de gramme près.


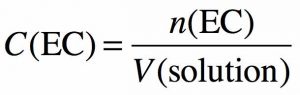
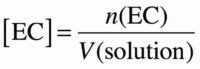


Dans l’exo 3 vous demander quelle masse de sel devra être prélevé mais la on parle de mol non?
Bonjour Zaed.
Merci pour ton retour. Il n’y a pas de coquilles. J’ai complété l’exercice en indiquant que les données de l’exercice ne nous permettent d’accéder qu’à la quantité de matière de sel. Mais à l’aide de la formule de la masse molaire, on retombe bien sur la masse de sel à prélever. Il faut faut faire 2 calculs.
merci bcp ! ça ma bcp aidé :3
Merci du retour.
Dans l’exercice 5 les chifrre utilisés pour la détermination de la masse de nitrate de cuivre II à prélever sont erronés car la concentration C est de 0,0012 mol/L et non 0,0024
Bonjour Johnson. Merci d’avoir signalé la coquille : elle est corrigée.
Bonjour, je ne comprend pas comment on peut trouver la masse de sel dans l’exercice 3 avec uniquement la concentration molaire et le volume. Merci.
Bonjour Jung.
Il y a un corrigé détaillé sous l’énoncé ; si tu ne le visualise pas, changer de navigateur pourrait régler ce problème. En résumé, avec seulement le volume de solution et la concentration en quantité de matière, on ne peut atteindre que la quantité de matière. On retombera sur nos pattes en utilisant la formule de la masse molaire qui contient la masse que l’on recherche.
Merci pour les efforts fournis cela nous a permis de mieux comprendre les notions de concentrations dans diverses situations. Je sollicite quand même des exercices de synthèse pour approfondir nos connaissances et aussi des explications en ce qui concerne les outils de manipulations en terme de pratique je veux dire.
Bonjour. Merci pour le retour. Lorsque j’aurai plus de temps, je proposerai plus d’exercices.
bonjour l’exercice 3 est erronés la masse a trouver n’est pas 8,2 g mes 7,98 g voir 8 gramme en arrondissant,
preuve :
C=n/V
n=c*v
n=0,21*0,65
n=0,1365 mol
M=58,44 g/mol-1
n=m/M
m=n*M
m=0,1365*58,44
m=7,97706 g
m=8 g en arrondissant
Cordialement
Bonjour Arlequin. Tu as raison. Je te fais la même réponse que pour Amri.
Bonjour, pour l’exercice 3, le fait de le faire en 2 étapes et de pratiquer un arrondi 2 fois, apporte une erreur. Il est préférable de passer par :
m = n x M
= C x V x M
Et y faire l’arrondi à la fin. Ce qui donne, 7,977 g
Bonjour Amri. Tu as tout à fait raison. Voulant être le plus clair possible pour ceux qui ont des difficultés avec les exercices calculatoires, j’ai proposé une résolution qui décompose le raisonnement ; au détriment donc de la précision du calcul. J’ai apporté une modification dans ce sens à l’exercice 3. (Attention tout de même à tes CS)