Enoncé du premier principe de la thermodynamique
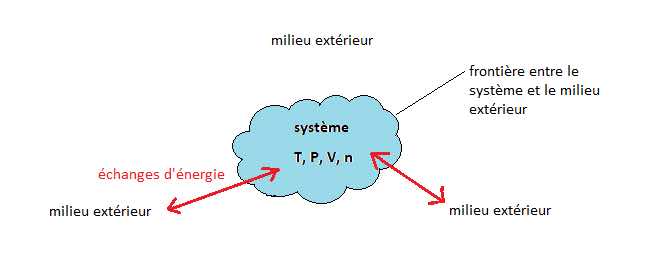
Soit un système fermé (=pas d’échange de matière) et au repos (ΔEM = 0 J), la variation de son énergie interne ΔU est due aux échanges d’énergie avec l’extérieur sous forme de travail W ou de transferts thermiques Q.
ΔU = W + Q
A voir dans ce cours
Autres cours à consulter
Que raconte ce principe ?
Thermodynamique vs Mécanique
La thermodynamique étudie le comportement interne thermique d’un système ; plus exactement, les causes mécaniques (travail W) et/ou thermique (transfert thermique Q) du milieu extérieur qui changerait son état thermique.
La mécanique étudie le mouvement d’un système et de la relation entre la masse et les forces extérieures pour expliquer ce mouvement : la 2sème loi de Newton. Elle ne se préoccupe pas de l’état interne du système.
Lien entre Thermodynamique et Mécanique
L’énergie totale Etotale d’un système prend en compte son énergie mécanique EM et son énergie interne U :
Etotale = Ec + Epp + U
Avec Ec (l’énergie cinétique en Joule), Epp (l’énergie potentielle de pesanteur en Joule) et U (l’énergie interne en Joule)
L'énergie interne U
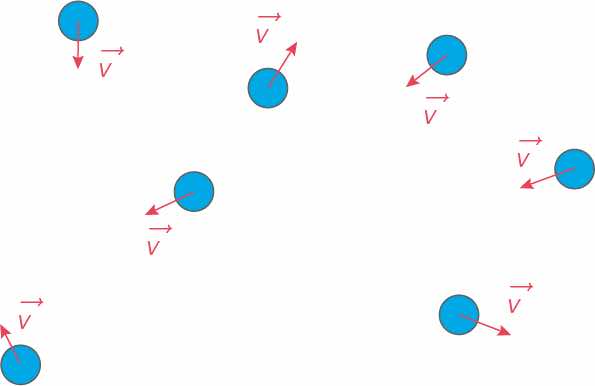
L’énergie interne U représente l’ensemble des énergies qui existent à l’intérieur de ce système du fait de la nature particulaire et lacunaire de la matière :
- Energie cinétiques microscopiques liées à l’agitation thermique des particules constitutif du système
- Energie potentielle d’interactions internes (=forces) entre les particules.

En mécanique classique, cette énergie interne U n’est pas prise en compte : on considère que l’agitation et les interactions au sein du système ne varie pas au cours du temps : ΔU = 0.
Que représentent W et Q ?
A l’aide des simulations d’expérience ci-dessous, réalisez le travail demandé.
Propriétés des gaz
Cette animation permet de visualiser les grandeurs mesurables d’un gaz (température, pression volume) et de les faire varier dans différentes situations.
Que représente le travail W ?
- En bas de l’animation, sélectionner « Idéale »
- Donner 3 coups de pompe pour atteindre une pression d’environ 17 atm ou 1700 kPa.
- Cocher « Largeur » à droite pour faire apparaitre une règle graduée.
Questions
- Notre système d’étude sera l’intérieur de cette enceinte : mesurer le volume V1 de notre système, sa température T1 et sa pression P1.
- Divisez par 2 le volume de notre système : vous appliquez un travail W sur notre système d’étude.
- Quelle grandeur change-t-elle ? A votre avis quelle énergie interne est affectée par ce travail ?
Que représente le transfert de chaleur Q ?
- En bas de l’animation, sélectionner « Idéale »
- Donner 3 coups de pompe pour atteindre une pression d’environ 17 atm 1700 kPa.
- Notre système d’étude sera l’intérieur de cette enceinte : mesurer le volume V1 de notre système, sa température T1 et sa pression P1.
- En chauffant notre système pour atteindre la température de 500 K, vous fournissez un apport d’énergie thermique extérieur Q.
- Quelle(s) grandeur(s) change-t-elle ? A votre avis quelle(s) énergie interne sera affectée(s) par cet apport d’énergie Q ?

