Attention :
- Pour la concentration en masse, ne pas confondre avec la masse volumique bien qu’elles partagent la même unité : g/L
- Le vocabulaire a évolué : concentration en masse = concentration massique
- Le vocabulaire a évolué : concentration en quantité de matière = concentration molaire
Définitions
Concentration en QUANTITE DE MATIERE
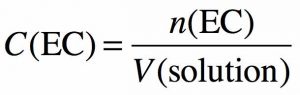
C’est la quantité de matière (n) d’EC dissoute par unité de volume (V) de solution.
Autre notation concentration en quantité de matière
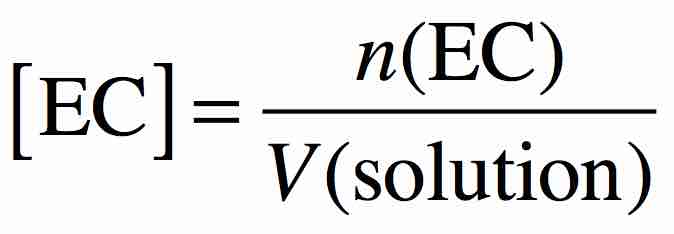
Cette notation entre crochet n’est utilisée QUE pour les espèces chimiques ioniques dissoutes en solution

Les concentrations
Vous pouvez faire varier les différentes paramètres (quantité de soluté, solvant) et ainsi constater l’évolution ou non de la concentration (en masse ou en quantité de matière).
Leurs unités
Concentration en MASSE
Dans la formule : Cm en g/L si m est en g et V en L Cm en kg/m3 si m est en kg et V en m3
Concentration en QUANTITE DE MATIERE
Dans la formule : C en mol/L si n est en mol et V en L C en mol/m3 si n est en mol et V en m3
Leurs instruments de mesure
Fiole jaugée + Balance :
Il faut mesurer la masse d’EC en g ou la quantité d’EC en mol à dissoudre avec la balance puis on versera le tout dans une fiole jaugée.


Leur écriture littérale
Concentration en QUANTITE DE MATIERE
C (CuSO4) = 0,096 mol/L
La concentration en quantité de matière de sulfate de cuivre dissout dans la solution est de 0,096 mol/L : cela signifie qu’on a dissout 0,096 mol de sulfate de cuivre dans 1 litre de solution.
C (sel) = 2,3 mol/L
La concentration en quantité de matière de sel (ou chlorure de sodium) dissout dans la solution est de 2,3 mol/L : cela signifie qu’on a dissout 2,3 mol de soude dans 1 litre de solution.
[H3O+] = 3,8 × 10-2 mol/L
La concentration en quantité de matière des ions oxonium dissout dans la solution est de 3,8 × 10-2 mol/L.
Concentration en MASSE
Cm (sucre) = 10 g/L
La concentration en masse de sucre dissout dans la solution est de 10 g/L : cela signifie qu’on a dissout 10 g de sucre dans 1 litre de solution.
Cm (soude) = 2,40 g/L
La concentration en masse de soude (ou hydroxyde de sodium) dissout dans la solution est de 2,40 g/L : cela signifie qu’on a dissout 2,40 g de soude dans 1 litre de solution.


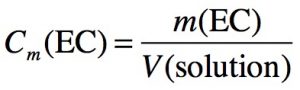
« C » ce n’est pas la concentration massique ?
Bonjour Harlay
Par convention, la concentration en masse (ou massique) se note « Cm » et la concentration en quantité de matière (ou molaire) « C ».
Ce sont des conventions ; elles peuvent donc légèrement changer d’un manuel ou d’un site à l’autre. Mais au lycée et post bac normalement, on les notera toujours ainsi.
Bonjour, est-ce que la concentration molaire C et massique Cm sont la meme chose ?
Bonjour May
Au fond, oui : elles sont liées à la quantité de soluté dissout dans un certain volume de solution.
Pour indiquer la quantité dissoute, le chimiste utilise soit la masse (en gramme) soit la quantité de matière (en mol). Ces 2 grandeurs représentent la même chose et sont liées par la formule m = n x M ; avec M la masse molaire qui est caractéristique du soluté.
Bonjour, je pense que dans le tableau des unités de mesure https://www.phychiers.fr/unites-grandeurs-et-mesures/
il y a une erreur sur l’unité de la concentration en quantité de matière c’est mol/L et non g/L ou kg/m3
Bonjour Alex. Oulala, en effet. Un copier-coller barbare est à l’origine de cette coquille. Merci.