« Rien ne se perd, tout se transforme » Lavoisier

Autres cours à consulter
Qu’est ce qu’une équation chimique ?
Dans une équation de réaction, on doit trouver comme informations :
- les formules chimiques brutes, semi-développée ou topologique des espèces chimiques (EC).
- les états physiques de chaque EC : (s) solide, (l) liquide , (g) gazeux, (aq) dissout
- des coefficients stœchiométriques qui permettent d’équilibrer l’équation.
Exemple d’équation de réaction chimique :
CH4 (g) + 2 O2 (g) → 2 H2O (g) + CO2 (g)
Traductions possibles de l’équation de réaction ci-dessus :
- 1 molécule de méthane (CH4) réagit avec 2 molécules de dioxygène (O2) pour former 1 molécule de dioxyde de carbone (CO2) et 2 molécules d’eau (H2O)
- 1 mole de molécule de méthane réagit avec 2 moles molécules de dioxygène pour former 1 mole molécule de dioxyde de carbone et 2 moles de molécules d’eau.
Equilibrer une équation de réaction
Les 2 principes de conservation
- conservation des éléments chimiques ou atomes : on doit retrouver autant d’éléments, atomes d’hydrogène H, oxygène O… dans les réactifs et les produits.
- conservation des charges électriques (lycée) : La charge électrique globale des réactifs doit être identique à la charge globale des produits.
Exemple :
3 Zn (s) + 2 Fe 3+ (aq) → 3 Zn 2+ (aq) + 2 Fe (s)
2 Fe 3+ signifie qu’il y a 6 charges électriques positives dans les réactifs.
3 Zn 2+ signifie qu’il y a 6 charges électriques positives dans les produits.
Il y a donc conservation des charges électriques.
Equilibrer pas-à-pas
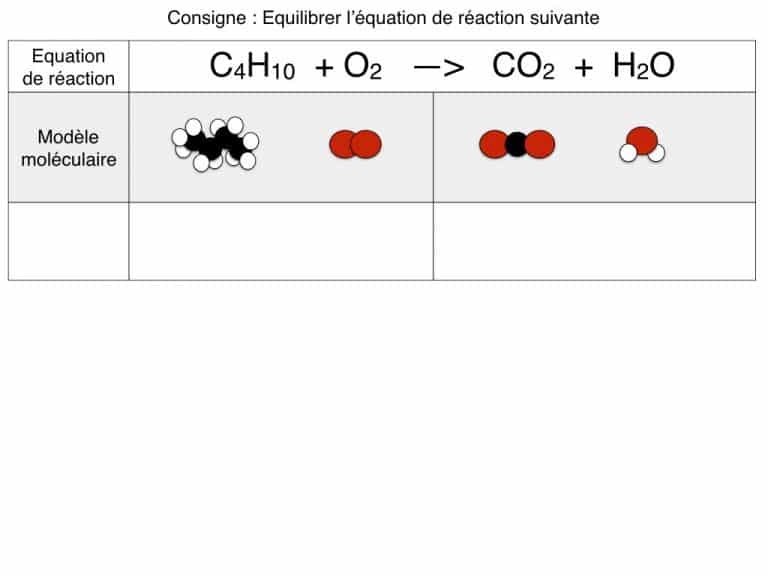
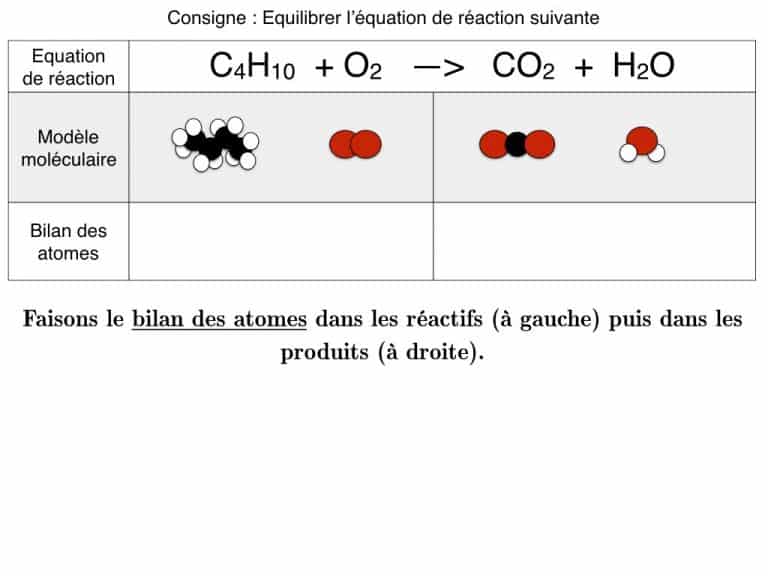
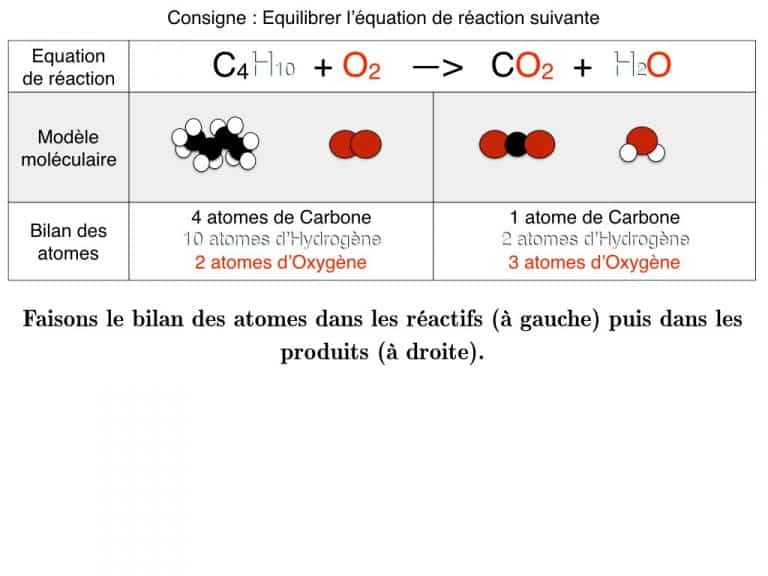
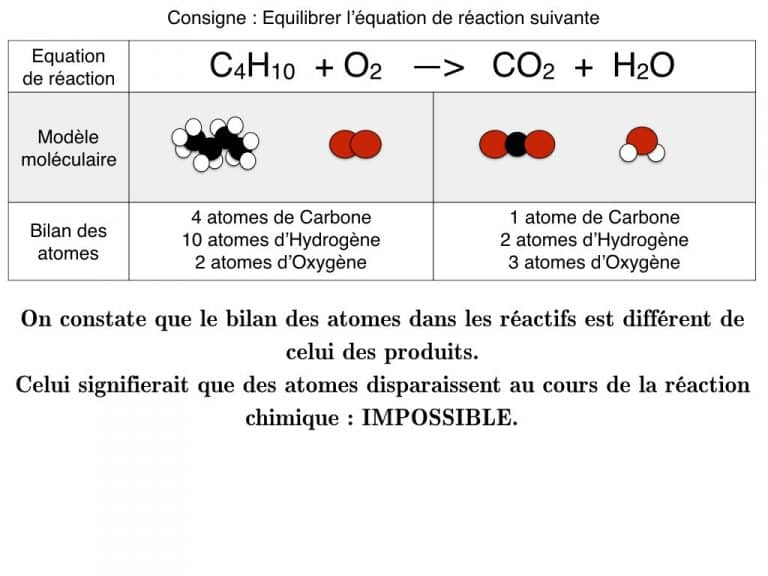
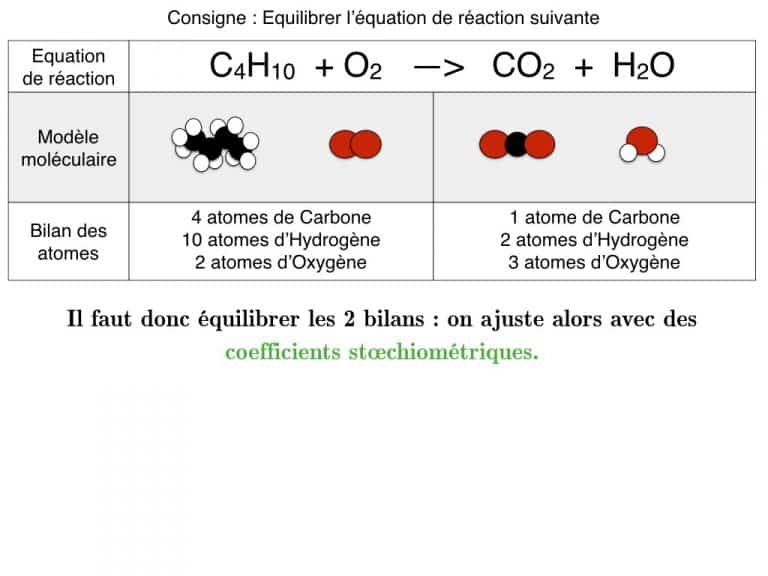
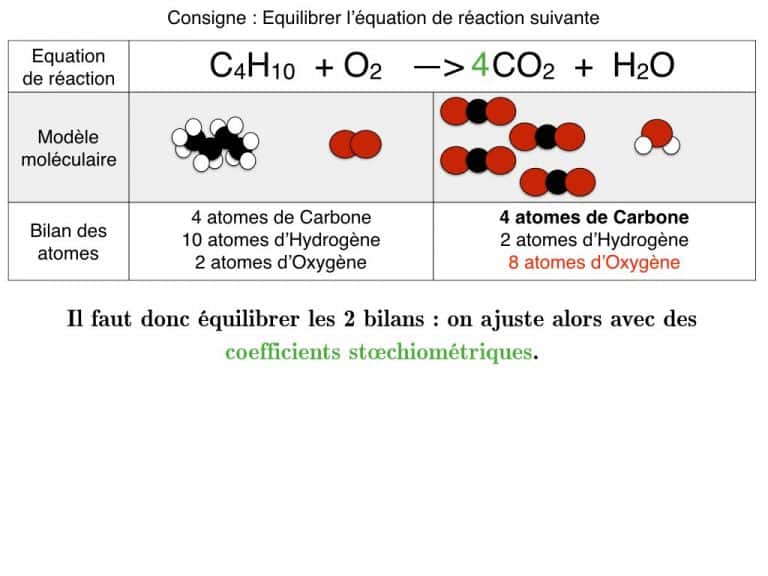
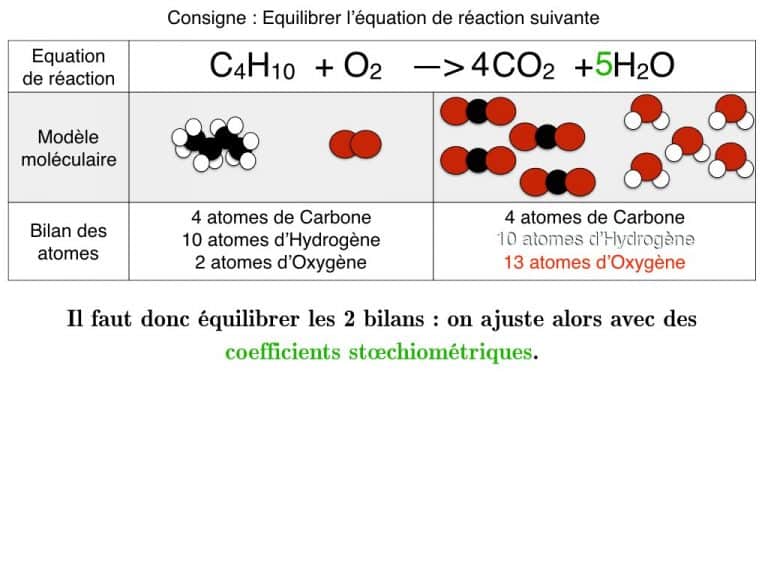
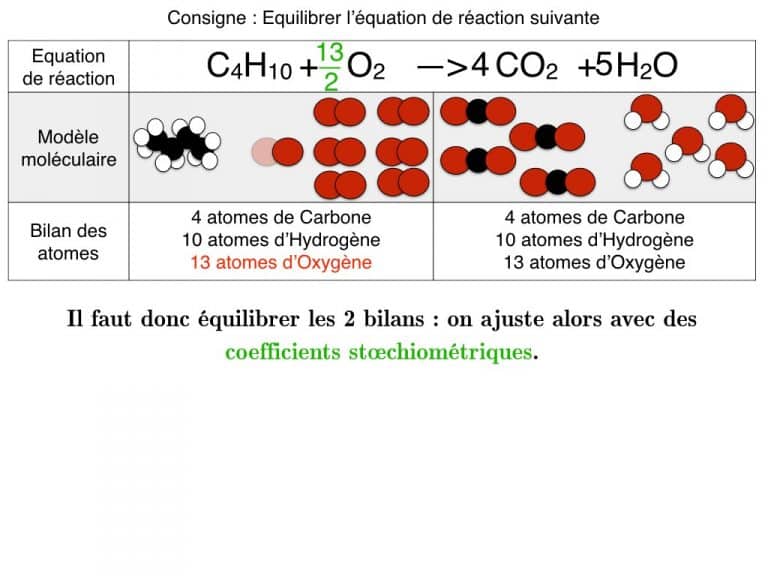
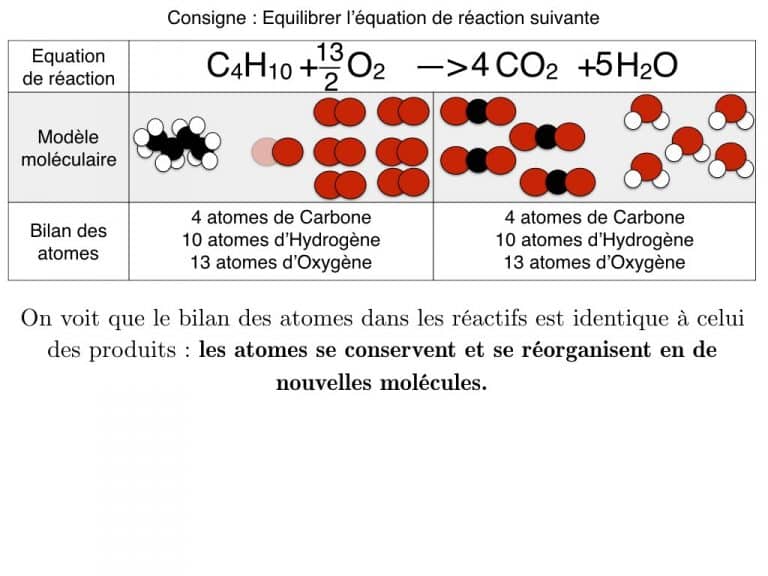
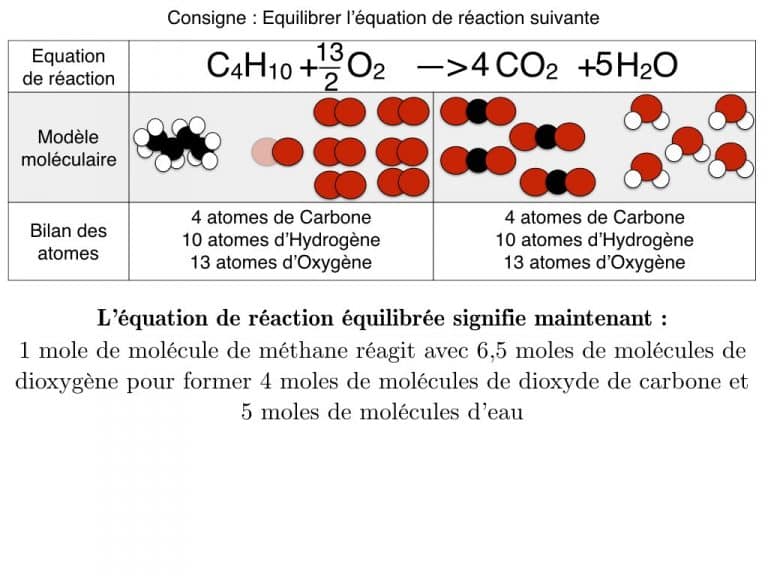

Equilibrer une équation de réaction
En exemple, vous pourrez suivre l’équilibrage de 3 réactions différentes pas à pas jusqu’à ce que les bilans soient identiques. En exercice, cette animation vous propose des défis à résoudre.
Equilibrer les équations de réaction
Source – physique-chimie.ac-normandie.fr
Source – ostralo.net
Source – PCCL.fr
Quiz sur les équations à équilibrer
Pour tester vos connaissances. A vous de jouer …



on doit mettre des nombre entier dans les coefficients stœchiométrique. 13/2 ne fonctionne pas il faut multiplier toute l’équation par 2
Bonjour Alice et Capucine.
Les conventions en chimie autorisent de mettre des coefficients avec demi.
Au collège, il peut être interdit de le faire car on représente ces coefficients comme un nombre de molécules ou d’atomes : il est alors bizarre de parler de moitié de molécules ou de moitié d’atomes…
Au lycée et post bac, cela est permis car on présente les coefficients comme des quantités de matières en mol.
Par contre les tiers ou quarts sont interdits : on perdrait en lisibilité.